İlk olarak 1903 yılında kullanılan “klon” ifadesi özellikle son yıllarda sağlık bilimleri çevresinde çokça duyduğumuz bir kavram haline gelmiştir. Yunanca’da “aynı kökten yeni dallar üretmek” anlamına gelen söz, tek bir atadan eşeysiz üreyen organizmaları tanımlamak için kullanılsa da yıllar içinde hayvanlarda uygulanarak gerçek anlamına ulaşmıştır diyebiliriz.
Kaynak : https://www.acibadem.com.tr
Klonlama tekniğine baktığımızda iki ana alt kavrama ayrıldığını görürüz: Üretim ve Tedavi Amaçlı Klonlama. Üretim amaçlı klonlamalar çeşitli tartışmalara sebebiyet vermesiyle beraber kimi biliminsanı tarafından insanoğlunun kurtuluşu olarak görülmektedir. Üzerine araştırmalar yapılması her ne kadar engellenmeye çalışılsa da diğer tekniğe göre daha yavaş bir ilerleme ile üretici klonlama da gelişim göstermektedir. Bu makalede ise kök hücre ve klonlama üzerine bir izlenimden sonra Tedavi Edici Klonlama’ya ayrıntılı olarak değinildi ve bulunan çeşitli kaynaklar derlenerek tekniğe farklı bir bakış açısı ile bakıldı.
Kök hücre kavramı da klonlamayla beraber hayatlarımıza giren ve sonrasında da çıkmamış bir kavram olmasıyla beraber, kaynak gerekliliği ve kaynağın nereden sağlanacağı gibi sorunlar ile bilimsel tartışmalarımızın ana konuları arasında kendine yer edinmiştir. Bilim dünyası bu sorunların çözümüne en az tekniğin kendisine kafa yordukları kadar kafa yormaktadırlar; çünkü yeniden üretim, yeniden onarım gibi belki de ütopik gözüken hayaller için altın kilit noktası “kök hücre”den geçmektedir.

Kaynak : https://riedercloningproject.weebly.com
Klonlama, aslına bakılırsa doğada binlerce yıldan beri varolan bir “sürdürülebilirlik yöntemi”dir. Bakterilerin, mantarların, bitkilerin binlerce yıldır kendilerini aynen aktarmalarını sağlayan, kullandıkları doğal klonlama teknikleridir. İnsanoğlu ise 1970li yıllar itibariyle ancak genlerin ayrı ayrı elde edilmesiyle başlayan çalışmalarla moleküler klonlama üzerine gidebilmiştir. Gelişen teknikler ve teknoloji ile sonraki süreçte hücre klonlaması ve bunun önce tek hücreli organizmalarda başarılı sonuçlar vermesi, döneminin insanına geleceğin habercisi niteliğinde sonuçlar vermekteydi. Bizim konumuz olan Terapötik yani Tedavi Edici Klonlamada ise Somatik Nükleer Gen Transferi dediğimiz yöntem gün geçtikçe yaygınlaşmakta ve bilimsel çevreler tarafından da kabul görmektedir. Kişiye özel doku ve organ üretimi, hücre replasman terapileri, hastalık teşhis ve tedavileri ile tıp biliminde büyük umut vaat etmiş bir yöntemdir.
Bütün bunların yanında kök hücre kavramının hayatımıza girişiyle beraber etik tartışmaları da yükselmiştir ki bundan günü geldiğinde terapötik klonlamaların da payını alması kaçınılmazdı. İnsanoğlunun ilk embriyonik hücre ekstraksiyonlarını ve bunların üzerinde yapılan çalışmaları deneyimlemesiyle sıra hayvanlardan insanlara geldiğinde tartışmalar artık iyice alevlenmişti. Gerek bilimsel gerekse de siyasi sebeplerden bir “yapay insan” üretme fikrinin de ortaya çıkışıyla beraber insan embriyosu üzerinde yapılan çalışmalara belli kurallar getirmek bir zorunluluk haline geldi. Daha sonrasında erişkin kök hücre çalışmalarının iPSC gibi yöntemlerle sürdürülmesi üzerine bu etik tartışmalar hafiflemiş gibi gözükse de bu yöntemin de kendine özgü etik problemleri bulunuyordu.
Peki, tedavi edici klonlama geleceğe tutulmuş bir deniz feneri mi yoksa içerdiği prosedür bakımından pimi çekilmiş ve her an patlamaya hazır bir el bombası mı? Yanlış ellerde bu denli büyük potansiyele sahip bir buluş nelere yol açabilir? Gelecekte insanoğlunu neler bekliyor? Bilim, kurtuluşa ve özgürlüğe artık tahmin ettiğimizden çok daha yaklaşmış olabilir mi?
Klonlama
Klon ifadesi ilk olarak 1903 yılında Webber tarafından, tek bir atadan eşeysiz üreyen organizmaların oluşturduğu kolonileri tanımlamak için kullanılmıştır. Yunanca’da “aynı kökten yeni dallar elde etmek” anlamına gelen klonlama, bir bitki dalından yüzlerce benzer bitki üretme ilkesinin hayvanlara uygulanmasıyla gerçek anlamına ulaşmıştır.[3]
Bugünkü anlamıyla DNA parçalarının, genlerin ve hücrelerin ya da orijinalinin aynısı bireylerin üretimi olarak tanımlanabilmektedir.[4] Bir canlı hücre çekirdeği, çekirdeği alınmış bir başka hücre yumurtasına yerleştirilerek spermsiz döllenme sağlanır.[5]
Kaynak : https://www.bioedge.org
Klonlamanın üretim ve tedavi olmak üzere iki farklı amacı vardır. Üretim amaçlı (reprodüktif) klonlamada insan embriyosu, hücresi ve hücreye bağlı unsurların tamamıyla bir bireyin, tam ve sağ bir insanın üretilmesi amaçlanırken; tedavi amaçlı (terapötik) klonlamada ise embriyo, hücre ve hücreye bağlı unsurlar kullanılarak tedavi ve iyileştirme hedeflenir.[6] Güncel tartışmalar genellikle üretim klonlaması ve bu amaca hizmet edecek embriyolojik kök hücre üretiminin meşruluğu konusundadır. [7]
Tedavi Amaçlı (Terapötik) Klonlama
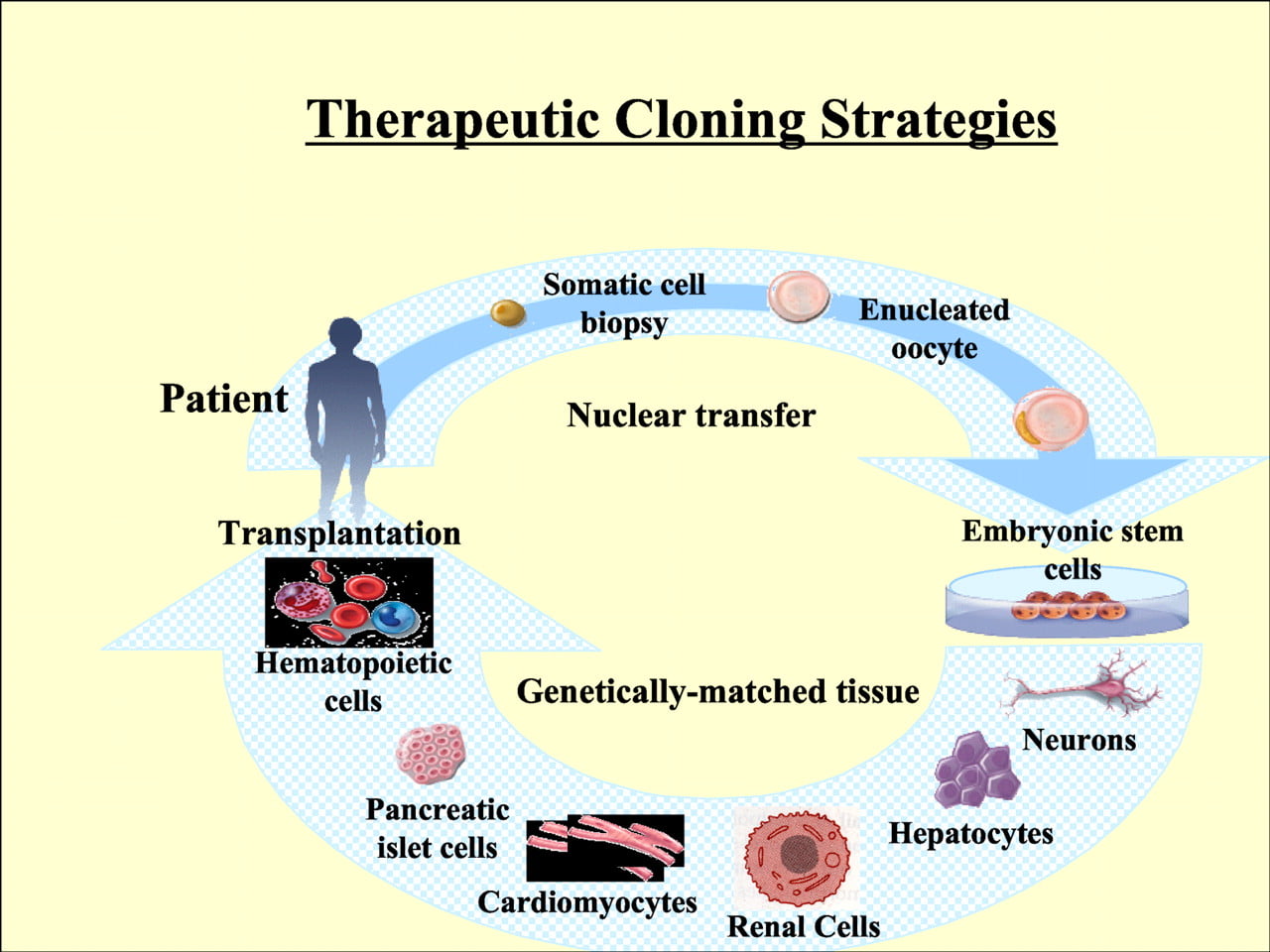
Bilim, doku mühendisliğiyle üretilen dokuların tedavi amaçlı kullanılmasını hedeflemektedir. [8] Uygulanan teknoloji aslında bireyin klonlanması için gerçekleştirilen sistemin aynısıdır fakat farklı olarak, elde edilen embriyo bir kadının rahmine transfer edilmez. Gelişimi, blastosist aşamasına ulaşana kadar laboratuvar şartlarında sağlanır. Bu aşamada embriyolardan alınan embriyonik kök hücreler spesifik prekürsör hücrelere ve somatik hücrelere diferensiye olabilmektedir. Bu yolla elde edilen hücreler, hastanın kendi genetik yapısına sahip olduğundan (mitokondriyal DNA hariç) immünolojik uyumsuzluk sorunu ortaya çıkmamaktadır. [9] Bu durumda, bu hücrelerden geliştirilecek olan dokular, klonlanan kişi için birer yedek doku veya organ teşkil edecektir.[5]
Terapötik (tedavi) klonlamaya ayrıca embriyo klonlama da denir. Araştırmalarda kullanılmak üzere insan embriyosunun üretilme işlemidir. Kök hücrelerin yetiştirilmesinde insan gelişiminin ve hastalıkların tedavisinin araştırılması ve çalışılması amaçlanır.
İleri sürülen bir görüşe göre; hayvan deneylerinde bile kendini ispatlamamış bu klonlamada terapi henüz uzak bir umuttur ve “tedavi amaçlı” olarak nitelendirilmesi, bu kavrama temeli olmayan bir değer yüklemektedir. Bu görüşe göre “araştırma klonlaması” daha yerinde bir adlandırmadır.[10] Ancak bu terim, buradaki süreci açıklamaktan çok örtmektedir. Ve bununla birlikte aynı terimin üretim amaçlı klonlama için etiketlenmesi durumu ortaya çıkacaktır. Bu sebeple üretici ve tedavi amaçlı şeklindeki niteleme konuyu açıklamaya daha uygun olmakla birlikte, bu şekilde araştırma klonlamasının sınırı da belirlenmiş olmaktadır.[8]
Kök hücreler vücutta herhangi bir hücre tipine başkalaşabilme potansiyeline sahip temel hücrelerdir. Çoğalabilme, kendini yenileyebilme, bulunduğu dokuyu onarabilme gibi çeşitli özelliklere de sahiptir.
Elde edilebilme kaynaklarına ve farklılaşabilme kapasitelerine göre sınıflandırılabilirler.
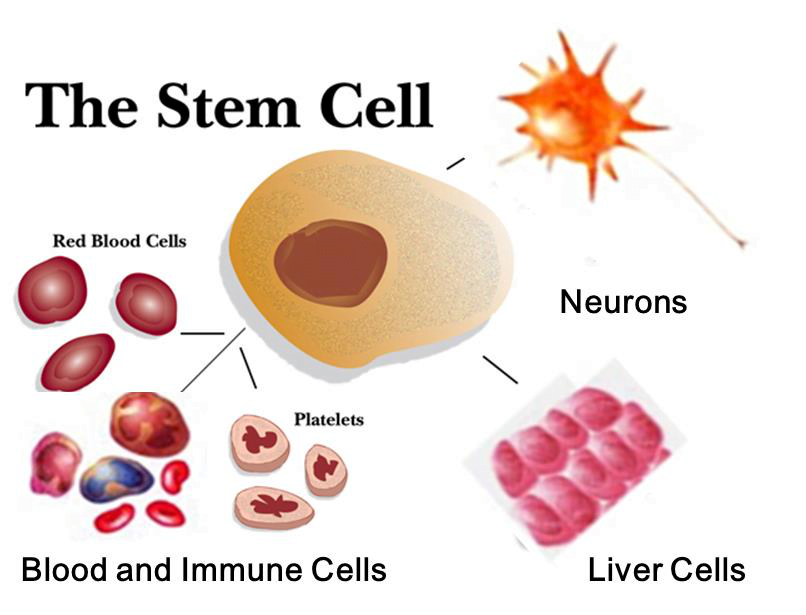
Kaynak : https://www.creativebiomart.net
Embriyonik kök hücreler: Embriyodan (blastosist) elde edilirler ve çoğunlukla tüm vücut hücre tiplerine dönüşebilme özelliğine sahiptirler. Bu sebeple pluripotent hücreler de denebilir.
Erişkin / Somatik kök hücreleri : Gelişimini tamamlamış farklı yaşlardaki bireylerde belirli dokulardan saflaştırılabilirler(bulunabilir ve elde edilebilirler). Lakin özellikleri daha spesifiktir. Öncelikli olarak bulundukları dokuları korur ve onarımında rol alırlar. Ve beyin, kan damarları, karaciğer, deri gibi pek çok yerde bulunabilir. Erişkin kök hücrelerin başka hücrelere dönüşebilme yeteneğine kök hücre plastisitesi denilir. Dönüşüm her zaman başka hücreye olmayabilir. Uygun koşullar sağlanır ise daha ilkel forma döndükten sonra da farklılaşma gerçekleşebilir.
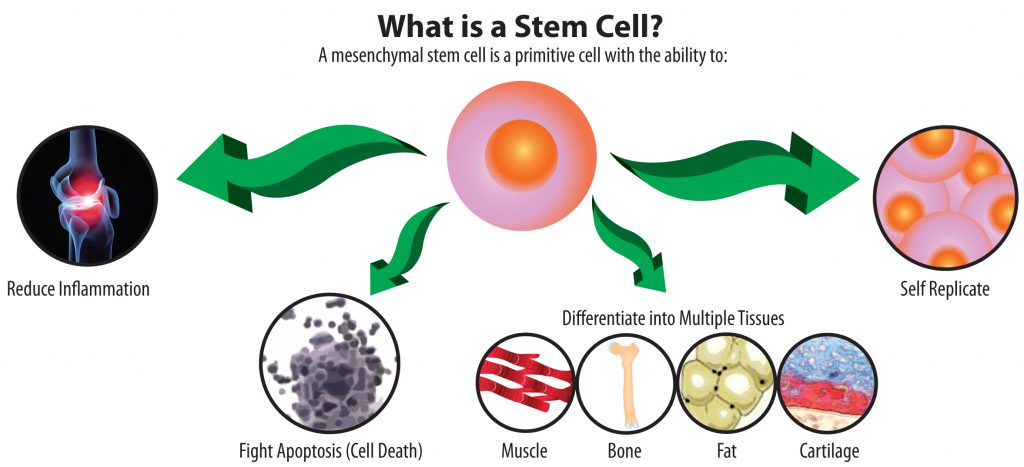
Kaynak : https://revolutionsdocs.com
Yapılan araştırmalar sonucu ayrıca indüklenmiş pluripotent ve amniyotik kök hücreler isimleriyle de nakil işlemleri gerçekleşebilmektedir. Kök hücrelerin bilinen üç ana kaynağı vardır ve bunlar kemik iliği, periferik kök hücre ve kordon kanıdır.
Klonlama, doğal ve yapay yollarla genetik olarak birbirine tıpatıp benzeyen organizma veya yapıların üretilmesi işlemidir. Doğadaki klonlamayı biz aslında eşeysiz üreme olarak biliyoruz. Biyoteknolojide ise hücre veya DNA fragmanlarının kopyalanması (moleküler klonlama) ve organizmaların tıpatıp bir kopyasını oluşturmayı(kopyalama) kapsamaktadır.[17]
Doğal Klonlama
Bazı canlı türlerinin günümüze kadar gelmesini sağlamış üreme yöntemidir aslında. Bakteriler mantarlar, bitkiler ve ayrıca klonal koloniler bu yöntemi kullanmaktadırlar.[17]
Kaynak : https://jasn.asnjournals.org
Moleküler Klonlama
1970lerden önce genleri ayrı ayrı elde edemediğimiz için klonlama alanındaki çalışmalarımız bu tarihten sonraya kalmıştır. Bakteriyofajın büyümesini engelleyen bakterilerde keşfedilen endonükleazlar bu klonlamanın önünü açan bir keşifti. Bu bakterilerden izole edilen endonükleazlar sadece belli DNA sekanslarıyla karşılaştığında DNA molekülünü parçalıyordu. Ve sonra DNA ligazların da keşfi ile endonükleazlarla elde edilen DNA parçaları farklı kombinasyonlarda birleştirilerek rekombinant DNA denilen DNA molekülleri elde edilmiştir.[18]
Moleküler klonlamada canlıların DNAsının temel yapısının aynı olması gerçeğinden faydalanılmaktadır. Bu sayede elde edilen DNA segmenti, replikasyon için gerekli sekansları içeren bir organizmaya sokulduğunda bu transgenik organizmada konakçı hücrenin DNAsıyla birlikte yabancı DNA da elde edilmiş olur.[18]
Moleküler klonlama ve polimeraz zincir reaksiyonu, DNA dizisinin replikasyonuna izin verdikleri için birbirine benzerler ancak moleküler klonlama canlı bir organizma içinde DNA çoğaltılması iken PCR in vitro ortamda DNAnın amplifikasyonudur.[18]
Kaynak : http://cloningtherapeutic.blogspot.com
Adımlar
Standart moleküler klonlama deneylerinde, herhangi bir DNA fragmanının klonlanması esasen yedi aşamayı içerir[18]:
- Konakçı organizma ve klonlama vektörünün seçimi,
- Vektör DNA’nın hazırlanması,
- Klonlanacak DNA’nın hazırlanması,
- Rekombinant DNA’nın oluşturulması
- Rekombinant DNA’nın konak organizmaya girmesi,
- Rekombinant DNA içeren organizmaların seçilmesi,
- İstenen DNA eklerine ve biyolojik özelliklere sahip klonların taranması.
Konakçı organizma ve klonlama vektörü seçimi
Plazmitler, bakteriyofajlar, cosmid vektörler, bakteri, maya, memeli ve insan yapay kromozomları vektör olarak kullanılmaktadır.[19] Ancak deneylerin çoğunda E. colinin bir laboratuvar suşu ve plazmid kullanılır. E. coli ve plazmid, yaygın olmaları, minimum ekipmanla rekombinant organizmanın hızlı bir şekilde büyümesini sağlamaları ve çok yönlü olmaları nedeniyle beraber kullanılmaktadırlar.[18] Klonlanacak DNAnın büyük olduğu durumlarda ise (yüzbinlerce ila milyon baz çift), genellikle bakteriyel veya maya yapay kromozom vektörü tercih edilir.[18]
Hangi vektör ve konak seçilirse seçilsin deneyin başarısı için vektör ve konakta bulunması gereken dört DNA segmenti olmalıdır [18]:
- DNA replikasyon orijini: Vektörün (ve bağlı rekombinant sekansların) konak organizma içinde replike olması için gereklidir.
- Restriktif endonükleaz tanıma bölgesi: Yabancı DNAnın tanıtılabileceği bölgeler
- Marker gen: Vektör sekanslarını alan hücrelerin hayatta kalmasını sağlamak için kullanılabilecek genetik materyal
- Etiket geni: Yabancı DNA içeren hücreleri taramak için kullanılabilecek bir gen
Vektör DNA hazırlanması
Seçilen klonlama vektörü yabancı DNAnın uçlarıyla uyumlu bir konfigürasyon oluşturan bir restriksiyon enzimiyle (genellikle yabancı DNAnın kesildiği enzimle) işleme alınır. Ayrıca vektörde, yabancı DNA çoğalmasının anlaşılması için inaktivasyonu kullanılabilecek bir gen bölgesi tercih edilir. (sıklıkla beta galaktosidaz) Rekombinant DNA nın ekspresyonunu artırmak için ise vektör DNAsı genellikle alkalin fosfataz ile muamele edilir. Bu sayede vektörün fosforile olmuş DNAsı replikasyona katılamazken rekombinant DNA kısmı replike olmuş olur.[18]
Klonlanacak DNA hazırlanması
Büyük bir kısmı hasara uğramadığı müddetçe herhangi bir dokudan (soyu tükenmiş canlılardan alınan dokular dahil) alınan DNA a) kirletici proteinlerden (fenol ile ekstraksiyon) b) RNA parçalarında (ribonükleazlar ile) c) daha küçük moleküllerden (çökertme veya kromotografi ile) temizlenerek saflaştırılır. Klonlanma öncesinde spesifik DNA veya RNA(RT-PCR) dizilerinin çoğaltılması için PCR yöntemine sıklıkla başvurulur. [19] [18]
Deney için kullanılacak DNA, ters transkriptaz (tamamlayıcı DNA veya cDNA klonlama) kullanılarak RNA’dan(elde edilmek istenen hücrenin mRNA popülasyonunu temsil eden klonlar elde etmek için) veya sentetik DNA (yapay gen sentezi, hedef hücrenin kesin bir DNA sekansını elde etmek için ) formunda elde edilebilir.
En son elde edilen DNA, restriksiyon enzimi ile muamele edilerek vektöre bağlanabilecek uçlar oluşturulur. [18]
DNA ligaz ile rekombinant DNA oluşturulması
Bu basmak diğer basamaklara göre nispeten daha basit bir basamaktır. Lineer DNA uçlarıyla tanınabilen bir DNA ligaz enzimi uygun konsantrasyonda, vektör ve konaktan elde edilmiş DNAların uygun bölümlerini kovalent bağlarla birleştirir. Bu reaksiyon ligasyon olarak adlandırılır. Sonuçta oluşan DNA karışımı konakçı organizmaya girmeye hazırdır.[18]
Rekombinant DNA’nın konak organizmaya girmesi
Önceden in vitro olarak manipüle edilen DNA karışımı, konakçı organizma olarak adlandırılan canlı bir hücreye geri taşınır. DNA’yı hücrelere almak için kullanılan yöntemler değişkendir ve moleküler klonlama işleminde bu adıma uygulanan ad, genellikle seçilen deney yöntemine bağlı olacaktır.[18]
- Transformasyon: Özel büyüme rejimi ve kimyasal arıtma yöntemiyle hazırlanan ortamda mikroorganizmaların DNA’yı ortamdan alıp çoğaltabildikleri yöntem.[20]
- Transfeksiyon: Memeli hücre kültüründe, transformasyona benzer bir işlem.
- Elektroporasyon:DNA’yı hücre zarından (ve eğer varsa hücre duvarı) geçirmek için yüksek voltajlı elektrik darbeleri kullanılması.[21]
- Transdüksiyon: bakteriyofajlarla DNAnın hücre içine entegre edilmesi.
Elektroporasyon ve transdüksiyon diğer yöntemlere göre nispeten daha efektif yöntemlerdir.
Vektör dizileri içeren organizmaların seçimi
Yapay genetik seleksiyon basamağı olarak da adlandırılır. Rekombinant DNAyı alan hücelerin hayatta kalması ve diğerlerinin ortadan kalkması prensibi kullanılır. Mesela bakteriyel hücreler konakçı olarak kullanıldığında seçilebilir marker gen genellikle antibiyotiğe direnç sağlayan gendir. DNA karışımını taşıması beklenilen ortama bir miktar antibiyotik eklendiğinde antibiyotiğe direnç genini taşıyan rekombinant DNA molekülünü taşıyan hücreler hayatta kalacaktır.[18]
İstenen DNA ekleri ve biyolojik özellikleri olan klonların taranması
Modern bakteriyel klonlama vektörlerinin rekombinant DNAyı ekprese eden klonları ve vektör DNAsını eksprese eden klonları ayırmak için mavi beyaz tarama sistemini kullanılır. Enzim aktivitesi bölgesinden (genellikle beta oksidazın kodlandığı bölgeye yabancı DNA eklenir) birleştirilen bu klonlarda rekombinant DNA eklendiğinde enzim inaktive olarak beyaz görünecek, vektör DNAsını ekprese eden klonlar ise ortamda mavi renkli olarak gözlenecek. [18]
Sonuçta istenen DNA yapısının elde edildiğinden emin olmak için birkaç farklı klonun incelenmesi neredeyse her zaman gereklidir. Bu, nükleik asit hibridizasyonları, antikor probları, polimeraz zincir reaksiyonu, kısıtlama fragmanı analizi ve / veya DNA dizilimi dahil olmak üzere çok çeşitli deneysel yöntemlerle gerçekleştirilebilir.[18]

Kaynak : https://safetycord.com
Hücre klonlaması
Tek hücreli organizmaların klonlanması
Bakteri ve maya gibi tek hücreli canlılar uygun besiyerine ekimi yapıldığında klonlanabilir ama çok hücreliler için durum biraz daha karmaşıktır.
Klonlanma halkalarının kullanılması farklı hücre soylarının klonlanması için kullanılan bir hücre kültürü yöntemidir. Bir mutajenik maddeye veya ilaca yüksek konsantrasyonda maruz bırakılan hücreler erken büyüme evresinde birkaç hücrelik koloni olduğunda gres içine batırılmış steril polistiren halkalar (klonlama halkaları) her bir koloni üzerine yerleştirilir ve az miktarda tripsin eklenir. Klonlaşan hücreler halka içinde toplanır ve daha fazla büyümesi için ayrı bir kaba aktarılır.[22] [17]
Kök hücrelerin klonlanması
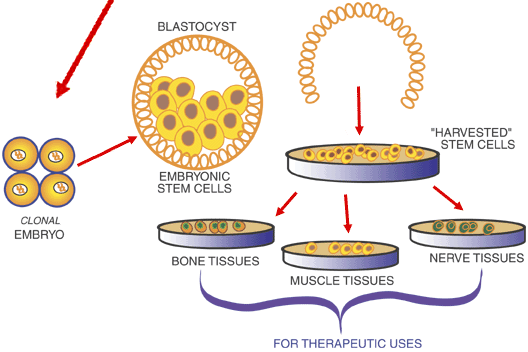
SCNT (Somatic cell transfer) laboratuvarda somatik bir hücre ile bir yumurta hücresinden canlı bir embriyo oluşturma yöntemdir. Bu yöntem üreme klonlanması(reprodüktif klonlama) ve terapötik klonlanma alt başlıklarıyla incelenmektedir.
Memelilerdeki ilk başarılı reprodüktif klonlama koyun Dolly olarak tüm dünya tanımıştı. SCNT’nin çiftlik hayvanı klonlanmasında ve aslında insan klonlanmasında da kullanılan basmaklar neredeyse hepsi için aynıdır. Ilk olarak somatik hücreler toplanır ardından yumurta hücresinin maternal DNAsı metafaz 2 de oositten çıkarılarak somatik hücrenin nükleusu oosite yerleştirilir. Oluşturulan embriyo gelişmeye başlaması için elektrik akımına maruz bırakılır. Başarıyla gelişen embriyolar taşıyıcıya nakledilir.[23]
Rejeneratif tıpta ise SCNT terapötik klonlama için kullanılmaktadır. Burada SCNT ile amaç kök hücre çalışmalarında kullanılmak üzere embriyo elde etmektir. Terapötik klonlamada amaç yeni bir canlı oluşturmak değil, insanın gelişim evrelerini incelemek ve potansiyel oluşabilecek bir hastalığın tedavisi için kök hücreleri toplamaktır.[23]
SCNT’nin klonlamada önemli bir yere sahip olmasının nedeni ise somatik hücrelerin çok kolay elde edilmesidir. Ayrıca SCNT’de, somatik hücrenin sadece nükleusu aktarıldığı için yumurta hücresinde bulunan mitokondriyal DNAlar da eksprese edileceği için elde edilen hibrit hücre somatik hücrenin aynısı olmamaktadır.[23]
Organizma klonlaması
Genetik olarak özdeş organizma üretilmesinin kapsar. Doğal ve yapay yollardan organizmalar klonlanabilmekle beraber biz burada yapay klonlamadan bahsedeceğiz.
Organizmaların yapay klonlanması
Organizmaların yapay klonlanması, ayrıca üreme klonlaması olarak da adlandırılabilir. Burada yukarıda bahsettiğimiz SCNT yöntemi çoğunlukla kullanılmaktadır. 1929 yılında alman embriyolog Hans Speeman ve öğrencisi somatik hücre nükleer transferini yapan ilk insanlar olmuşlardır.[24]
Diğer bir yöntem de yapay olarak embriyo bölünmesi veya embriyo izlemesi denilen yöntemdir. Farkı bir donör embriyosunun alınıp 6-8 hücreli aşamada ikiye bölünüp birbirinin aynısı iki embriyo oluşturulması işlemidir. Bu işlem daha çok IVF uygulamalarında başarı şansını artırmak için kullanılmaktadır.[25]
Terapötik Klonlama diğer adıyla Somatik Nükleer Gen transferi günümüzde ve yakın gelecekte gittikçe yaygınlaşan ve çeşitli alanlarda kullanılmaya açık bir tekniktir. Tıpta kişiye özel doku ve organ üretimi, rejeneratif tıpta hücre replasman terapisi, bazı hastalıkların teşhis ve tedavisi, hastalıklar ve genetik oluşumlarını açıklayan modeller meydana getirmeyi vaat etmesi sebebiyle son derece önemlidir.[26] Yapılan çalışmalara göz atacak olursak 2006 yılında D’Amour et al ve ekibi insan embriyonik kök hücrelerini insülin, glukagon, somatostatin, pankreatik polipeptit ve ghrelin dahil pankreatik hormonların çoğunu üretebilen endokrin hücrelerine dönüştürmeyi sağlayan bir farklılaştırma metodu geliştirdi.[27] Bu metod in vivo pankreatik organogenezi taklit ederek hücrelerin pankreas hücrelerinin gelişim aşamalarına yönlendirilmesine dayanmaktadır. Organ yapımının terapötik klonlama ile gerçekleştirebileceğine ve diabetus mellitus hastalığına çözüm olmaya dair umut vermesi sebebiyle önemli bir yenilik olarak görülmektedir.
Başka bir kullanım alanı ise nörodejeneratif hastalıklarda iyileşme sağlamaya yöneliktir.Bu hastalıklardan dopaminerjik nöronların hasarı sonucu çıkan titreme, kas katılığı gibi semptomlar gösteren Parkinson Hastalığı tedavisi için bir fare modelinde gelişmeler yaşandı. Fare embriyonik hücrelerinin nöral farklılaştırılması var olan metodlarla belirli nöral sistem alt hücre türlerine dönüşerek kısıtlı kalmaktır. Yapılan çalışmada ise farklı koşullar altında hızlı ve efektif dönüşüm sağlamakla beraber aynı zamanda hücrelerin beynin farklı bölümlerine dönüşecek şekilde uyarılmasıyla gama-aminobütirik asit (GABA), dopamin, serotonin ve motor nöron gibi alt türlere dönüşümü sağlanmıştır.[28] In vitro ortamda elektron mikroskobuyla takip sonucu üretilen türlerin nöral fonksiyonları gösterdiği saptanmıştır. Üretilen dopaminerjik nöronların fareye transplantasyonu olumlu sonuç vererek terapötik klonlamanın in vivo ortamda nöral hastalıklar için uygulaması gerçekleştirildi. Buradan yola çıkarak sadece Parkinson değil insanlarda görülen diğer nörodejeneratif hastalıkların tedavisindeki klinik uygulamalarda çok daha başarılı sonuçlar alınacaktır.

Kaynak : https://www.healthline.com
Terapötik klonlamanın gen terapisiyle birleştirilerek kullanımı Şiddetli Kombine İmmün yetersizlik gibi DNA rekombinasyonu için esansiyel olan bazı spesifik genlerin (Rag1 ve 2 vb) mutasyona uğraması sonucu çıkan kalıtsal genetik bozukluklar için büyük bir potansiyel vaat etmektedir. Bu konuda immün eksikliği olan Rag2(-/-) fareler oositlere çekirdek donörü olarak kullanıldı.[29] Gendeki mutant alellerden biri homolog rekombinasyonla tamir edildi ve genin bu yolla iyileştirilmesi sağlandı. Hematopoetik öncüler, onarılan hücrelerden in vitro farklılaşma ile türetildi ve mutant farelere aşılandı.Transplantasyondan birkaç hafta sonra olgun myeloid, lenfoid hücrelere rastlanmaya başlaması başarıya ulaşıldığını kanıtlamaktadır.
Kaynak : https://therapeuticcloning101.weebly.com
Yapılan çalışmalarda gelinen aşamalar sonucu terapötik klonlamanın klinikte gelecekteki uygulamalarına bir örnek[30] üzerinden değinecek olursak en sık rastlanılan kardiyovasküler hastalıklardan olan kalp krizinde hastaların çoğu hastaneye yetiştirilinceye kadar kalp hücreleri hastanın aktif yaşam kalitesini etkileyecek derecede zarar görmektedir. Hastadan alınacak deri hücrelerini örneğinin genetik materyali kullanılarak kromozomları çıkarılmış insan yumurta hücrelerine aktarımı sayesinde kalp hücrelerine dönüşme potansiyeli olan kök hücreler elde edilmiş olacaktır. Bu hücreler hastayla birebir uyumlu olduğu için doku ve organ transplantasyonunda sık karşılaşılan vücudun otoimmün tepki göstermesi engellenmiş olup hastaya nakil sonucu hasarlanmış hücrelerin yerine yenilerinin gelmesiyle hastanın hayat kalitesi değişmeyecektir.
Sonuç olarak terapötik klonlama yukarıda verilen örneklere ek olarak hemofili,kistik fibrozis,DMD (Duchenne Muskular Distrofi) gibi pek çok hastalığın tedavisinde, kanserin erken teşhisinin yapılmasında,yaşlanmaya karşı gelebilme potansiyeliyle tıpta pek çok alanda kullanılmaktadır ve gelecekte rutin klinik uygulamalarda daha sık yer alacaktır.
Kök hücre kavramı hayatımıza girdiği günden beri etik kaygıları da ortaya çıkarmaktadır. Etik konular, kök hücrenin elde ediliş yeri ve kök hücre nakillerindeki sorunlar üzerine yoğunlaşmaktadır.
Kök hücrelerin kontrolsüz çoğalması, onların farklı birçok hücreye farklılaşmasına sebep olmaktadır ve bu durum nakilleri zorlaştırmaktadır. Etik ilkeler, kontrolsüz çoğalmanın önüne geçilmesi ve nakil öncesi ve nakil sonrası tümör oluşumunun engellenmesi için önemlidir.
Ayriyeten kök hücreler embriyodan elde edildiği gibi erişkinlerden de elde edilebilir. Kök hücreleri, elde ediliş yeri açısından ikiye ayırabiliriz.
İnsan Embriyosu Kökenli Kök Hücrelerde Etik
Üreme tıbbındaki çalışmalar embriyonik çalışmaların temelini attı. 1990’ların sonlarından bu yana araştırmaların hedefi yeni terapötik uygulamaları bulmak oldu.[31] Araştırmacılar nükleusu çıkarılmış somatik hücreye dönör yumurtadan nükleus naklederek yeni bir koyun klonladı. Daha sonra dünya, insan embriyonik kök hücrelerinin ilk ekstraksiyonunu deneyimledi ve bu deneyimden yola çıkarak yapay insan yapmayı hedefledi. İnsan embriyosundaki yapılmak istenen çalışmalar kuralların olması gerekliliği ortaya koydu.
İnsan embriyonik kök hücrelerin(human Embriyonik Stem Cell, hESC) çalışılmasında 14 Günlük Kuralı uygulanmaktadır. Bu kuralın kabulu genel olarak iki noktaya bağlanmaktadır: ABD’de, 1979 Embriyo Araştırmaları üzerine Etik Danışma Kurulu’nun Sağlık, Eğitim ve Refah Dairesi (HEW) raporu ve Birleşik Krallık’ta, İnsan Döllenme ve Embriyolojiye İlişkin Warnock Soruşturma Komitesi’nin raporu. Bu saygın kuruluşlar, kuralın başka yerlerde yaygın bir etki kazanmasının nedenidir. Embriyo araştırmalarına izin veren hemen hemen her ülke, 14 günlük kuralının bir versiyonunu kullanmaktadır.
Yeni yayımlanan makaleler bu kuralın değişmesi veya esnetilmesi için nedenler sunmaktadır. Bu nedenleri temel anlamda ikiye ayırabiliriz: İnsan embriyoları kültürde birkaç günden fazla yetiştirilemiyordu. Oysa günümüzde yeni kültür teknikleri, embriyoların 14 günden daha uzun süre in vitro tutulmasının mümkün kılmaktadır. Örneğin, 2016 yılında iki grup bilim insanı, insan embriyosunun uterusa implante olduğu günden sonra in vitro ortamda yaşayamayacağı düşüncesini yaptıkları çalışmalarla çürüttüklerini bildirdiler.[32,33]
Bu çalışmalar, 14 günlük sınırı aşmanın teknik olarak mümkün olduğunu ve 14 günlük limite yaklaştıkça yeni bilgilere ulaşılabileceğini göstermektedir.
İkinci neden ise insan pluripotent kök hücrelerinin, belirli kültür koşulları sağlandığında, insan embriyosuna benzer şekilde kendi kendini organize edebilmesidir.[34]
Bu gibi çalışmaların önündeki sınırların kalkması; araştırmacılara, bilmediği birçok bilgiye ulaşmalarını sağlayacaktır. En azından mevcut kurallar tekrardan gözden geçirilmelidir.[35]
Etik kaygıların yanı sıra; hESC tabanlı tedavi ile ilgili güvenlik sorunları, transplantasyon için büyük sorun oluşturmaktadır. hESC’lerin yüzlerce farklı hücreye farklılanma özelliği in vivo ortamda kontrol edilmelerini zorlaştırmaktadır. Farklılaşmamış hESC transferi sonucunda teratom gelişmektedir. İmplantasyon alanında teratom görülmesi; hücre olgunlaşması, saflık ve uygulama tekniklerinin bağlıdır ve hESC nakledilmiş immün yetersiz farelerde teratom gözükme olasılığının 33-100% arasında olduğu bazı çalışmalarca ispatlanmaktadır.
Günümüzde, teratomun hESC transplantasyonundan sonra gelişmeyeceğinden emin olmanın tek yolu, enjeksiyondan önce onları arzu edilen ve olgun hücre tipinde ayırt etmek ve farklılaşmamış hücrelerin varlığını taramaktır. Prosedürlerin titizlikle takibi sonucu, hESC türevi kardiyomiyositler nakledilen 200’den fazla hayvanda teratomlar gözlenmedi[36]. Ama bu prosedürün izlenmesine rağmen bazı çalışmalarda hESC’lerin kontrolsüz bir şekilde farklılaştıkları gözlendi.[37]
Bu güvenlik kaygılarına rağmen, yakın zamanda yayınlanan veriler kontrollü şartlarda, hESC’den türetilen hücrelerin rejeneratif tıpta güvenli bir kaynak olarak hizmet edebileceğini ileri sürmektedir.[38]
Erişkin Kökenli Kök Hücrelerde Etik
IPSC (induced Pluripotent Stem Cell, iPSC), karyotip, fenotip, telomeraz aktivitesi ve farklılaşma kapasitesi bakımından hESC’lere çok benzemektedir. Ama iPSC’lerin, üretimleri embriyoların imha edilmesini gerektirmediğinden hESC’lerden etik açısından daha rahat çalışma imkanı sağlamaktadır.Takahashi ve Yamanaka, memeli somatik hücrelerinin ilk defa yeniden programlandığını gösterdi.[39] Ardından birçok araştırmacı, insan hücrelerinden de pluripotent hücre üretiminin mümkün olduğunu doğruladı.[40]
Bilim insanları süreç içerisinde embriyoların tahrip edilmeden, pluripotent hücre eldesini memnuniyet ile karşıladılar. iPSC hücreleri, araştırmacıların bağışlanan embriyolara bağımlılıklarını hafifletti ve bu nedenle klonlama araştırmalarında etik problemlerin hafiflediği söylenmektedir.
İPSC tabanlı tedavi ile ilgili ana güvenlik sorunu; farklılaşmamış İPSC’lerin kontrolsüz çoğalması ve istenmeyen farklılaşmaların geniş somatik hücreler aralığında tümörlerin üretilmesine ve / veya iPSC’lerin istenmeyen şekilde farklılaşmasına neden olabileceğinin düşünülmesidir. Dolayısıyla İPSC’lerin genomik istikrarsızlıklarını vurgulamak gerekir.[41]
Özellikle iPSC üretiminde kullanılan klasik yöntem pluripotent genleri viral vektörler aracılığı ile yerleştirmeyi kapsamaktadır. Ancak retroviral vektörlerin kullanılması, pluripotensi başlatan genlerin, host hücrelerde mutasyonlara neden olabilen host genomuna entegrasyonuna izin verir veya eklenen genler, host hücre farklılaşmaya uğradıktan sonra bile pluripotensi ağını yeniden etkinleştirebilir.[42]
Araştırmacılar tümör oluşumunu önlemek için birçok yeni yollar üretmeyi hedeflediler ve bunun için çalıştılar. Örneğin, somatik hücrelerin iPSC benzeri hücrelere yeniden programlanması için, hücrelerin asidik ortama batırılması ile transkripsiyon faktörü oluşumunun engellendiği söylenmektedir.[43]
Klinik araştırmalardaki araştırmacıların temel güvenlik kaygısı ise, iPSC’lerin ve iPSC’den türetilmiş nakledilen greftlerin, tümör gelişimi riskidir. iPSC’den türetilmiş greftler tamamen farklılaşmamış hücreler içeriyorsa, bu hücreler tümör oluşturma potansiyeline sahip olacaktır. Bu tür tümörlerin çoğu benign teratomlardır, ancak embriyonal karsinom gibi malign germ hücreli tümörlerin oluştuğu da bildirilmiştir.[42]
İPSC araştırmaların ilk başladığında etik kaygılardan uzak çalışma imkanı sağlayacağı düşüncesi günümüzde ortadan kalkmıştır ve İPSC tabanlı tedavilerde de etik kaygılar ön plana gelmiştir.
Geliştirilecek yeni yöntemler ile tümör oluşumu ve İPSC’lerin genomik istikrarsızlıkları engellendiği zaman etik kaygıların azalacağı ve çalışmaların daha da hızlanacağı görülmektedir.
Etik, özellikle kök hücre bazlı terapide ortaya çıkması muhtemel sorunların önüne geçse de; kök hücre bazlı terapinin kontrolü ve geleceği etik konular tarafından sınırlanmaktadır. Bu sınırlama yeni bilgilerin ulaşılmasını engellemektedir. Etik konuların tekrardan gözden geçirilmesi terapideki ilerlemenin hızını arttıracaktır.
Kısaca terapötik klonlamadan bahsetmek gerekirse, somatik bir hücreden izole edilmiş nükleer materyalin, nükleer donör ile aynı genom ile embriyonik hücre çizgilerini türetmek amacıyla bir çekirdeklenmiş oosit içine aktarılmasıdır.[44] Etik açıdan bazı soru işaretleri barındırsa da gelecekte farklı tedavi yöntemlerinin önünü açan bir teknolojidir. Üreme ve klonlama etiği ve biyomedikal yasalar hala belirsiz bir şekilde formüle edilmiş ve havada asılı kalmıştır. Peki bu teknolojinin geleceğinde bizi neler bekliyor? Kesin bir tedavisi bulunmayan bazı hastalıkların terapötik klonlama sayesinde çözüme ulaşabileceğine inanılıyor. Örneğin; kardiyovasküler, diyabetik, karaciğer, sinirsel hastalıklar tedavisi bulunacağına inanılan hastalıklar arasında yer alıyor.[45] Güncel yapılan çalışmalara göre bir grup bilim adamı terapötik klonlamayı kullanarak bir grup Parkinson hastalığına sahip fareyi, beyinlerine sağlıklı hücreyi yerleştirerek iyileştirmeyi başardılar.[46] Gelecekte de buna benzer bir yöntem kullanarak diyabet hastalığını tedavi etmeyi planlıyorlar. Farelerden alınacak olan embriyonik kök hücreleri pankreasa yerleştirilerek insülin üretimini arttırmayı hedefliyorlar.[47] Kök hücrelerinin kendine has karakterleri yüzünden kanser çalışmalarında da dikkatleri çekmektedir. Özellikle metastatik kanserlerde tedavi ve ameliyatla iyileşme yüzdesinin düşük olduğunu düşünürsek kök hücre tedavisi onlar için büyük bir gelecek vaat ediyor. [48] Tedavi etmeye yönelik olarak CRISPR tekniğinde kullanılan Cas9 enzimi sayesinde in vitro koşullarda karaciğer yetmezliğine çözüm bulmak için sağlıklı karaciğer dokusunu klonabilir. Böylece hem nakil sırası beklemekten hem de zaten kendi vücut dokusundan elde edildiği için doku uyuşmazlığından kurtulmuş olunacak.[49]
Bu makalede, hayatımıza girdiği ilk andan bu yana bilimsel tartışmalarımızın merkezine yerleşmiş klonlama kavramı ve akabinde bir alt kavram olarak tedavi edici klonlama hakkında bir derleme hazırlamaya çaba sarf ettik. Konu hakkındaki büyük tartışmaların başlıca sebebi ise üretici ve tedavi edici klonlamanın ana prosedürlerinin aynı olması ve yanlış ellerde bu tekniğin istenmeyen sonuçlara yol açabilecek oluşudur. Tedavi edici klonlama için de temel olarak araştırma amaçlı insan embriyoları üretilmektedir ve hayvan deneylerinde bile yeterli bir seviyeye ulaşamamış bu tekniğin “tedavi edici” olarak isimlendirilmesi kimi görüşlere göre temelsiz bir değer katmak olarak düşünüldüğü için “araştırma klonlaması” olarak isimlendirilmesi uygun bulunmuştur. Ancak bu da yanlış bir ifade olacaktır; çünkü bu terim uygulanan prosedürü yeterince karşılayamamaktadır.
Çoğalabilme, kendini yenileyebilme ve bulunduğu dokuyu onarabilme özellikleri sayesinde kök hücreler klonlama faaliyetleri için ideal materyallerdir. Embriyonik ve erişkin/somatik olmak üzere iki ana tip kök hücre bulunmaktadır ve yapılan araştırmalarla bunlara ek olarak indüklenmiş pluripotent ve amniyotik kök hücreler ile de nakil işlemleri gerçekleştirilebilmektedir. Kök hücreleri elde etmek için kullandığımız kaynakların başında kemik iliği, periferik kök hücre ve kordon kanı gelmektedir.
Teknik ve yöntemler açısından klonlamayı incelediğimizde ise dikkatimizi ilk çekecek olan doğada binlerce yıldır süregelen doğal klonlama olacaktır. Bakteriler, mantarlar ve bitkiler soylarını bu şekilde değişmeden devam ettirme kapasitesine sahiptirler. İnsanlar ise 1970lerden itibaren moleküler klonlama ile ilk çalışmalara başlamışlardır. Bu teknikte canlıların DNA temel yapısının aynı olması gerçeğinden faydalanılır ve elde edilen segment, replikasyon için gerekli sekansları içeren bir organizmaya sokulduğunda bu transgenik organizmada konakçı hücrenin DNAsıyla birlikte yabancı DNA da elde edilmiş olur. Daha sonraki yıllarda bakteri ve maya gibi tek hücreli canlıların uygun besiyerine ekimi yapılarak klonlanması sağlanmıştır. Tek hücreli canlılarda fazlasıyla başarılı olabilen klonlama, çok hücreli canlılar için çok daha karmaşık bir süreç gerektirir. Kök hücre klonlamasının başlaması ise geleceğin bir habercisi olmuştur. Somatic Cell Nuclear Transfer (SCNT) yöntemiyle somatik hücre ve yumurta hücresi kullanılarak canlı bir embriyo oluşturulması başarıyla sağlanmıştır. SCNT’ye bir kolaylık sağlayan somatik hücre kullanımının en büyük sıkıntısı, şu an için dünyada böyle bir deponun bulunmuyor oluşudur. Böylece üreme ve terapötik klonlama kavramları da literatüre giriş yapmıştır. Üretici klonlamanın memeliler için ilk başarılı örneği koyun Dolly olmuştur; ancak çeşitli etik tartışmalar sebebiyle insan klonlaması (bildiğimiz kadarıyla) henüz denenmiş değildir.
Konu üzerine süregelen etik tartışmalar, özellikle kök hücrenin elde ediliş yeri ve kök hücre nakillerindeki sorunlar üzerine yoğunlaşmaktadır. Kök hücrelerin kontrolsüz çoğalması, nakil sonrası tümör oluşumu da çokça düşünülen etik sorunlardandır. Ancak ana sorunu embriyonik kök hücreler oluşturur. Araştırmalar sonucu belirlenen “14 günlük kuralı” ile insan embriyolarının kültürde beklediği süre, doğal süresiyle sınırlandırılarak sorun çözümlenmiş gibi gözüktüyse de zaman içinde 14 günlük sınırı aşmanın yolları bulundu ve bu kuralın gözden geçirilmesi gerekliliği ortaya çıktı. Doğrusunu söylemek gerekirse, çalışmaların önündeki engellerin kaldırılması, araştırmacıların bilinmeze ulaşmaları konusunda onlara yardımcı olacaktır. Ancak konu üzerine yeterliliği olmayan kimselerin eline geçtiğinde şahısları büyük güvenlik problemleri beklemektedir.
Bu problemlerin yarattığı endişelere rağmen, kontrollü şartlarda üretilen insan embriyonik kök hücreleri rejeneratif tıpta güvenli bir kaynak olarak hizmet edecektir. Embriyonik kök hücre sorunlarının ardından erişkin kök hücrelerinin indüklenmesiyle “indüklenmiş pluripotent kök hücre” (iPSC) tekniğinin bir süre için tartışmaları azalttığını söyleyebiliriz. Ne yazık ki bu dinginlik hali de pek uzun sürmeyerek tümör oluşumu ve teknikteki genomik istikrarsızlıklar büyük etik kaygılar yaratmıştır.
Terapötik klonlama, günümüzün git gide popülerleşen bir alanı haline gelen Kişiselleştirilmiş ve Rejeneratif Tıp için temel oluşturmaktadır. Bu sayede insanın gelişim evreleri incelenerek, potansiyel hastalıkların da tedavisi araştırılmaktadır. İnsan embriyonik kök hücreleri farklılaştırılarak pankreatik organogenez evreleri indüklenip yapay bir pankreas üretilerek diabetes mellitus hastalığının tedavisine dair büyük gelişmeler sağlanmıştır. Bunun yanında Parkinson gibi nörodejeneratif hastalıkların terapötik klonlama yöntemiyle tedavi edilmesine dair çalışmalar başarılı klinik sonuçlar vermektedir. Terapötik klonlama ve gen terapisi birleştirilerek Şiddetli Kombine İmmün Yetersizlik gibi kalıtsal genetik hastalıklar tedavi edilebilir ve daha da ötesinde hemofili, kistik fibrozis, Duchenne Muskuler Distrofisi gibi hastalıkların tedavisinde, kanserin erken teşhisinde, yaşlanmayı engellemede kullanılması gelecekte planlanan uygulamalarından sadece bir kısmıdır.
Sonuç olarak görüyoruz ki tedavi edici klonlama, insanoğlu için geleceğe tutulmuş yeni bir umut ışığı olma yolunda emin adımlarla ilerliyor. Ancak, yüzyılın getirdiği diğer tıbbi yeniliklerle beraber insan ırkının geleceğinin ne yönde şekilleneceği konusundaki büyük etik tartışmalar da alevlendiği ilk günden bu yana sönmüyor. Dürüst olmak gerekirse, tedavi edici klonlamanın daha da gelişmesi ve gün geçtikçe yeni fırsatlar doğurmasıyla beraber yanında artan bir etik problemler yığını getireceğini tahmin edebiliriz. Bu fırsatlar bilinçli kullanıldığı takdirde, türümüzün -her ne kadar fütüristik bir kavram olsa da- “geliştirilmiş insan”a dönüşümünün başladığını söylemek, hiç de abartı olmayacaktır.
- ️http://www.wikizeroo.net/m/index.php?q=aHR0cHM6Ly9lbi5tLndpa2lwZWRpYS5vcmcvd2lraS9IZXJiZXJ0X0pvaG5fV2ViYmVy
- ️http://www.deu.edu.tr/UploadedFiles/Birimler/16928/klonlama.pdf, (E. T. 10.11.2013).
- ️Metin, Sevtap. (2010). Biyo-Tıp Etiği ve Hukuk, XII Levha Yayınları, İstanbul, s. 182
- ️Lisker R (2003) Ethical and Legal Issues in Therapeutic Cloning and the Study of Stem Cells. Arch Med Res; 34: 607–611.
- ️Çetin Gürsel/Demircan Tunç/Hot İnci/Eraslan Berna Şenel/Seyalıoğlu İrem. (2007). Klonlamaya Genetik, Etik ve Hukuksal Açıdan Yaklaşım, Adli Tıp Dergisi, 21 (2); s. s. 31.
- ️Hillebrand/Lanzerath/Wachlin. (2002). Klonen-Stand der Forschung, ethische Diskussion, rechtliche Aspekte, 2. Auflage, s. 25.
- ️Alman Federal Meclisinin 30.1.2002 tarih ve BT-Dr. 14/8102 sayılı kararı, Dederer, H-G. (2002). Menschenwürde des Embryo in vitro? AÖR 127, p. 1, s. 1 ff.
- ️Rossenau, Hennig, (2004). Yeniden Canlı Üretimi, Tedavi Edici Klonlama Tartışmaları ve Alman Kök Hücre Kanunu, Çev. Hakan Hakeri, Tıp ve Ceza Hukuku, Seçkin Yayınları, Ankara, s. 46-47.
- Wobus AM (2001) Potential of embryonic stem cells. Mol Aspec Med; 22: 149–164.
- Höfling. (2001). Zeitschrift für Medizinische Ethik, 47, s. 277, 278; Witteck/Erich, s. 258.
- http://www.kemikiligi.org.tr/icerik.php?id=137
- http://www.kemikiligi.org.tr/icerik.php?id=132&alt_id=162&tab=0
- https://www.ncbi.nlm.nih.gov/pubmed/28353258 /Stacey G
- https://www.ncbi.nlm.nih.gov/pubmed/28353259
- https://www.sciencedirect.com/book/9781785482540/stem-cells – book-description
- https://www.sciencedirect.com/science/article/pii/S0195561618301281
- https://en.wikipedia.org/wiki/Cloning
- https://en.wikipedia.org/wiki/Molecular_cloning
- Lüleyap, H. Ümit. Moleküler Genetiğin Esasları. Adana: Nobel Kitabevi, 2008.
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1205797/
- https://www.ncbi.nlm.nih.gov/pubmed/2659971
- https://www.ncbi.nlm.nih.gov/pubmed/10650336
- https://en.wikipedia.org/wiki/Somatic_cell_nuclear_transfer
- “Cloning Fact Sheet”. Human Genome Project Information. Archived from the originalon 2 May 2013. Retrieved 25 October 2011.
- https://www.ncbi.nlm.nih.gov/pubmed/1921709
- Charlotte Kfoury. Therapeutic cloning: promises and issues. Mcgill J Med. 2007 Jul; 10(2): 112–120. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2323472/
- D’Amour KA, Bang AG, Eliazer S, Kelly OG, Agulnick AD, Smart NG, Moorman MA, Kroon E, Carpenter MK, Baetge EE. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nat Biotechnol. 2006 Oct https://www.ncbi.nlm.nih.gov/pubmed/17053790
- Barberi T, Klivenyi P, Calingasan NY, Lee H, Kawamata H, Loonam K, Perrier AL, Bruses J, Rubio ME, Topf N, Tabar V, Harrison NL, Beal MF, Moore MA, Studer L. Neural subtype specification of fertilization and nuclear transfer embryonic stem cells and application in parkinsonian mice. Nat Biotechnol. 2003 Oct;21(10):1200–7. https://www.ncbi.nlm.nih.gov/pubmed/14502203
- Rideout WM, 3rd, Hochedlinger K, Kyba M, Daley GQ, Jaenisch R. Correction of a genetic defect by nuclear transplantation and combined cell and gene therapy. Cell. 2002 Apr 5;109(1):17–27. https://www.ncbi.nlm.nih.gov/pubmed/11955443
- https://www.bio.org/articles/value-therapeutic-cloning-patients
- Ethical questions concerning research on human embryos, embryonic stem cells and chimeras.Biotechnol J. 2006 Dec;1(12):1352-69.
- Self-organization of the in vitro attached human embryo. Nature. 2016 May 12;533(7602):251-4. doi: 10.1038/nature17948. Epub 2016 May 4.
- Self-organization of the human embryo in the absence of maternal tissues. Nat Cell Biol. 2016 Jun;18(6):700-708. doi: 10.1038/ncb3347. Epub 2016 May 4.
- A method to recapitulate early embryonic spatial patterning in human embryonic stem cells.Nat Methods. 2014 Aug;11(8):847-54. doi: 10.1038/nmeth.3016. Epub 2014 Jun 29.
- How and Why to Replace the 14-Day Rule. Curr Stem Cell Rep. 2018;4(3):228-234. doi: 10.1007/s40778-018-0135-7. Epub 2018 Jul 16.
- Laflamme MA, Gold J, Xu C. et al. Formation of human myocardium in the rat heart from human embryonic stem cells. Am J Pathol. 2005;167:663–671.
- Roy NS, Cleren C, Singh SK. et al. Functional engraftment of human ES cell-derived dopaminergic neurons enriched by coculture with telomerase-immortalized midbrain astrocytes. Nat Med. 2006;12:1259–1268.
- Song WK, Park KM, Kim HJ. et al. Treatment of macular degeneration using embryonic stem cell-derived retinal pigmentepithelium: preliminary results in Asian patients. Stem Cell Reports. 2015;4:860–872.
- Takahashi K, Yamanaka S. Fare embriyonik ve yetişkin fibroblast kültürlerinden pluripotent kök hücrelerin tanımlanmış faktörlerle indüksiyonu. Hücre. 2006; 126 : 663-676.
- Concise review: Induced pluripotent stem cells versus embryonic stem cells: close enough or yet too far apart? Bilic J1, Izpisua Belmonte JC. Stem Cells. 2012 Jan;30(1):33-41. doi: 10.1002/stem.700.
- (Yoshihara M, Hayashizaki Y, Murakawa Y. iPSC’lerin Genomik Kararsızlığı: Klinik Uygulamalarına Yönelik Zorluklar. Kök Hücre Rev. 2017; 13 : 7–16.
- Ethics of iPSC-based clinical research for age-related macular degeneration: patient-centered risk-benefit analysis. Nakano-Okuno M1, Borah BR, Nakano I. Stem Cell Rev. 2014 Dec;10(6):743-52. doi: 10.1007/s12015-014-9536-x.
- Obokata H, Wakayama T, Sasai Y, et al. Stimulus-triggered fate conversion of somatic cells into pluripotency. Nature. 2014;505(7485):641–647. doi: 10.1038/nature12968.
- Kfoury, C. (2019). Therapeutic cloning: promises and issues. Retrieved from https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2323472/
- Bakhshinyan D., Introduction to Cancer Stem Cells: Past, Present, and Future. – PubMed – NCBI. (2019). Retrieved from https://www.ncbi.nlm.nih.gov/m/pubmed/28986882/-
- Therapeutic Cloning Treats Parkinson’s Disease In Mice. (2008). Retrieved from https://www.sciencedaily.com/releases/2008/03/080323210229.htm
- Kolata, G. (2019). The Promise of Therapeutic Cloning. Retrieved from https://www.nytimes.com/2003/01/05/weekinreview/the-promise-of-therapeutic-cloning.html
- Zhang, C., Huang, T., Wu, B., He, W., & Liu, D. (2017). Stem cells in cancer therapy: opportunities and challenges. Retrieved from https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5650462/
- Bak RO, e. (2019). CRISPR/Cas9 genome editing in human hematopoietic stem cells. – PubMed – NCBI. Retrieved from https://www.ncbi.nlm.nih.gov/m/pubmed/29370156/
Editör :
Berkay Akad Ülker – İstanbul Tıp Fakültesi
Yazarlar :
Seda Sezen – Yıldırım Beyazıt Üniversitesi Tıp Fakültesi
Melike Toprak – Marmara Üniversitesi Fizyoterapi ve Rehabilitasyon
İrem Aktar – İstanbul Üniversitesi Tıp Fakültesi
Dilge Kocabaş – Ekonomi Üniversitesi Tıp Fakültesi
Hamza Doğukan Erfırat – İnönü Üniversitesi Tıp Fakültesi
Ebranur Kocabaş – İstanbul Üniversitesi Tıp Fakültesi

